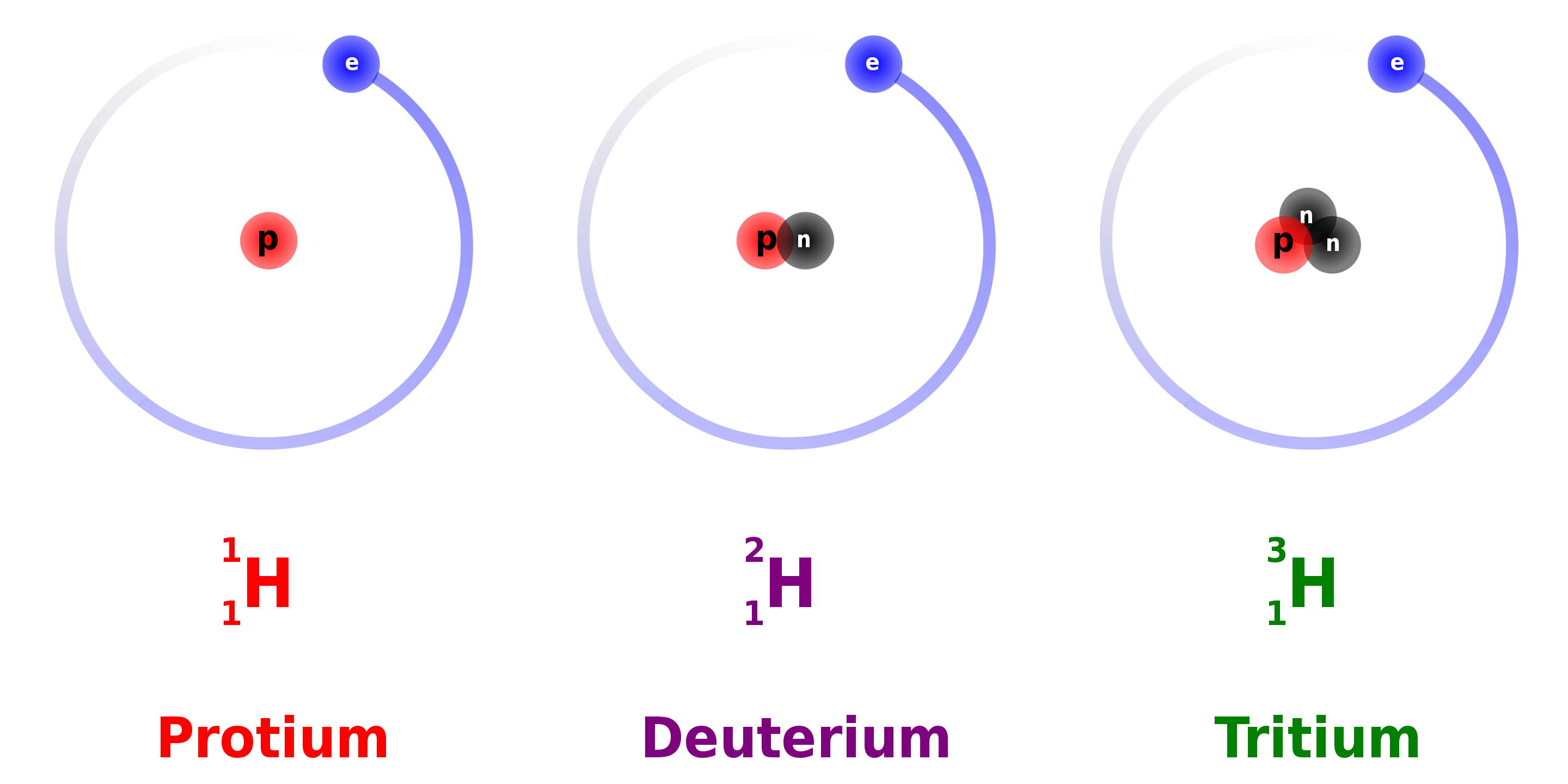
同位素指的是同一種化學元素,卻有不同的核種,也就是原子核裡的質子數相同,但中子的數量不一樣。以往科學家都認為每個元素都是獨一無二的,從不曾設想過同位素的可能性,加上同一種元素的同位素所表現出來的化學性質都毫無二致,也不可能在化學實驗中發現異狀,那麼同位素是怎麼發現的?
元素蛻變
1901 年的某一天,24 歲的索迪(Frederick Soddy)在實驗室中興奮地喊道:「拉塞福,這是蛻變現象 (transmutation)!」,拉塞福聽到後眉頭一皺,回說:「看在上帝的份上,不要叫它蛻變吧!他們會把我們當成煉金術士砍頭的。」

是的,蛻變是煉金術士長久以來追求的聖杯,也就是將某種元素轉變為另一種元素,以求將一般金屬變成黃金。當然一直沒有人能做到,如今索迪發現密封的放射性元素釷竟然自發性地蛻變為鐳,才不禁這麼脫口而出。
索迪出生於 1877 年 9 月 2 日,大學畢業後在牛津大學做了兩年的研究員,接著於 1900 年來加拿大的麥基爾大學(McGill University),追隨拉塞福做放射性的研究。
放射性是法國物理學家貝克勒(Henri Becquerel)於 1896 年無意間發現的,他將底片用黑色紙板密封後,跟鈾鹽一起放入抽屜,幾天後底片拆封,竟然感光了,因而發現鈾鹽會放射出某種神祕的能量。從此科學界掀起研究放射性的熱潮,拉塞福也是其中之一。他於 1899 年,進一步區分出放射線有 α 與 β 兩種,不過仍沒有人知道放射線究竟是什麼。
索迪跟著拉塞福做了兩年研究後,回到英國繼續研究放射性,他發現存放鐳的密封罐中竟憑空出現惰性氣體氦,寫信向拉塞福報告,拉塞福進一步實驗後,才於 1907 年確認鐳發出的 α 射線原來就是氦原子核,因此才產生氦氣。
鈾的衰變鍊
索迪後續研究鈾的衰變時,發現鈾在最終變成鉛之前,大約有 40 種衰變反應,問題是,鈾和鉛在週期表上中間只有 9 種元素,那麼在這麼多不同反應中出現的新原子究竟是什麼元素?又該如何放進週期表?

當時週期表仍是按原子量的大小排列,雖然有少數金屬元素的位置得重新調換,化學性質的規律性才能符合,但大致上已知元素都已在週期表各安其位,實在沒有理由再予推翻。因此索迪的發現受到大家質疑,認為他的實驗有問題。
1913 年,拉塞福另一位門生莫斯利(Henry Moseley)以陰極射線(高速電子)撞擊不同金屬元素,發現若按所產生X光的頻率高低順序,重新排列週期表,便會呈現化學性質的週期性。這是一項重大突破,元素週期表從此可以用客觀的數據制定,而不是靠人為介入調整。
索迪發現在新的週期表上,放射性元素的衰變鍊便有了明確的路徑,元素釋出一個 α 粒子,會變成它左邊第二格的元素;釋出一個 β 粒子則會變成緊鄰它右邊的元素。他便依此在 1913 這一年發表「位移法則」。

圖片來源:Wikipedia
根據位移法則,不同元素可能會經過不同路徑而衰變成同一元素,但原子量卻不一樣;例如鈾-235釋出會 α 粒子而衰變成釷-231,但錒-230經過 β 衰變卻成為釷-230,兩者都是釷,但原子量不同。索迪便把不同原子量的同一元素稱為「同位素」。
索迪因為發現同位素而於 1921 年獲頒諾貝爾化學獎。第二年獲獎的亞斯頓(Francis Aston)也在 1913 年發現同位素,但發現的途徑則完全不同……。
陽極射線
亞斯頓於 1877 年 9 月 1 日出生於英國,比索迪早了一天。不過 1900 年索迪進入拉塞福的實驗室時,亞斯頓則因為在校時曾研究酒石酸化合物的光學性質,而受聘到一家釀酒廠工作。三年之後,索迪已經發現釷會蛻變為鐳,以及鐳會產生氦氣,亞斯頓才重返伯明翰大學,轉而研究起近乎真空的玻璃管中,微量氣體的放電現象。

亞斯頓在氣體放電管的研究引起 J. J. 湯姆森的注意。湯姆森之前證明陰極射線是種帶負電的粒子,也就是後來所稱的電子。當時只知道電子的質量與電荷的比值固定不變,直到1909年密利根以油滴實驗測出基本電荷的大小,才能推算出電子的質量。湯姆森想用陽極射線管研究陽極射線,也就是失去電子而帶正電的氣體離子,利用同樣原理推算不同元素的質量,便在1910年,邀請亞斯頓前來劍橋大學的卡文迪許實驗室和他一起研究。
亞斯頓發揮巧思,將照相機整合到陽極射線管,可以拍下氣體離子的運動軌跡。1913年,他們拍到氖離子兩道不同的軌跡,經過計算,一條軌跡的原子量是20,接近氖的原子量20.2,另一條軌跡的原子量則是22。索迪不久前剛發表同位素的主張,亞斯頓認為原子量22的就是氖的同位素,但湯姆森不以為然,認為那只是二氫化氖。

圖片來源:Wikipedia
質譜儀
由於第一次世界大戰隨即在第二年爆發,亞斯頓被徵召服役,無法繼續研究,直到戰爭結束才返回卡文迪許實驗室。此時新的主任正是拉塞福,他非常鼓勵亞斯頓繼續研究同位素。1919 年,亞斯頓將離子源、質量分析器與偵測器結合在一起,打造出質譜儀(註),可以直接根據「質量-電荷比」算出各種同位素的質量,還能測出它們的豐度。亞斯頓據此證實的確有氖-20與氖-22兩種同位素,而且兩者比例是 10比 1,這也解釋了為什麼平常測量氖的原子量是 20.2。

亞斯頓繼續用質譜儀鑑定其它 53 種非放射性元素,結果發現了 212 種同位素,證明即使是穩定的元素也普遍存在同位素。他同時也一舉解決了長久以來的未解謎題:如果元素都是由原子組成,而氫是最基本的元素,為什麼其它元素測得的原子量並不是氫原子量的整數倍?原來元素的每個同位素都是氫原子量的整數倍,只是進行測量時,混雜了元素的同位素,平均下來的原子量也就不是整數了。
有了亞斯頓的實驗結果,索迪的同位素主張終於獲得大家認同,索迪隨即於 1921 年獲得諾貝爾化學獎。而第二年的諾貝爾化學獎便頒予亞斯頓,以表揚他發明質譜儀發現大量同位素,並闡述了原子量的「整數法則」。
亞斯頓出生後的第二天,索迪出生;索迪得諾貝爾獎的隔年,亞斯頓得獎;索迪在 1913 年發現放射性元素的同位素,亞斯頓則在同年發現非放射性元素的同位素;兩人先後都跟過拉塞福。這麼多巧合,不禁讓人覺得他們倆的人生際遇就像是同位素一樣,雖然各自獨立,卻又如影隨形。
核能
亞斯頓還有件事值得一提。他在諾貝爾獎的演講中,主張同位素的發現表明原子核必定受到巨大的能量束縛,他說:「如果未來的研究人員發現釋放這種能量的方法,並能付諸實現,人類將擁有超出科幻小說夢想的掌控能力。」到了 1936 年,亞斯頓更加確定當年的預言必將成真,他說:「有一天,人類將釋放並控制它(核能)幾乎無限的力量。 我們只能希望他不會專門用它來炸毀他的隔壁鄰居。」亞斯頓大概沒想到,這次的警語不到十年就一語成讖了。
註:加拿大物理學家登普斯特 (Arthur Dempster) 在前一年也發明了質譜儀
參考資料:
- Frederick Soddy – Wikipedia
- Francis William Aston – Wikipedia
- Nobel medal sale highlights work of forgotten chemist who predicted the atom bomb | Nobel prizes | The Guardian
- (99+) The Modern Alchemists: Francis Aston and Frederick Soddy. (A Chapter from “Celestial Twins”) | Elizabetha Levin – Academia.edu